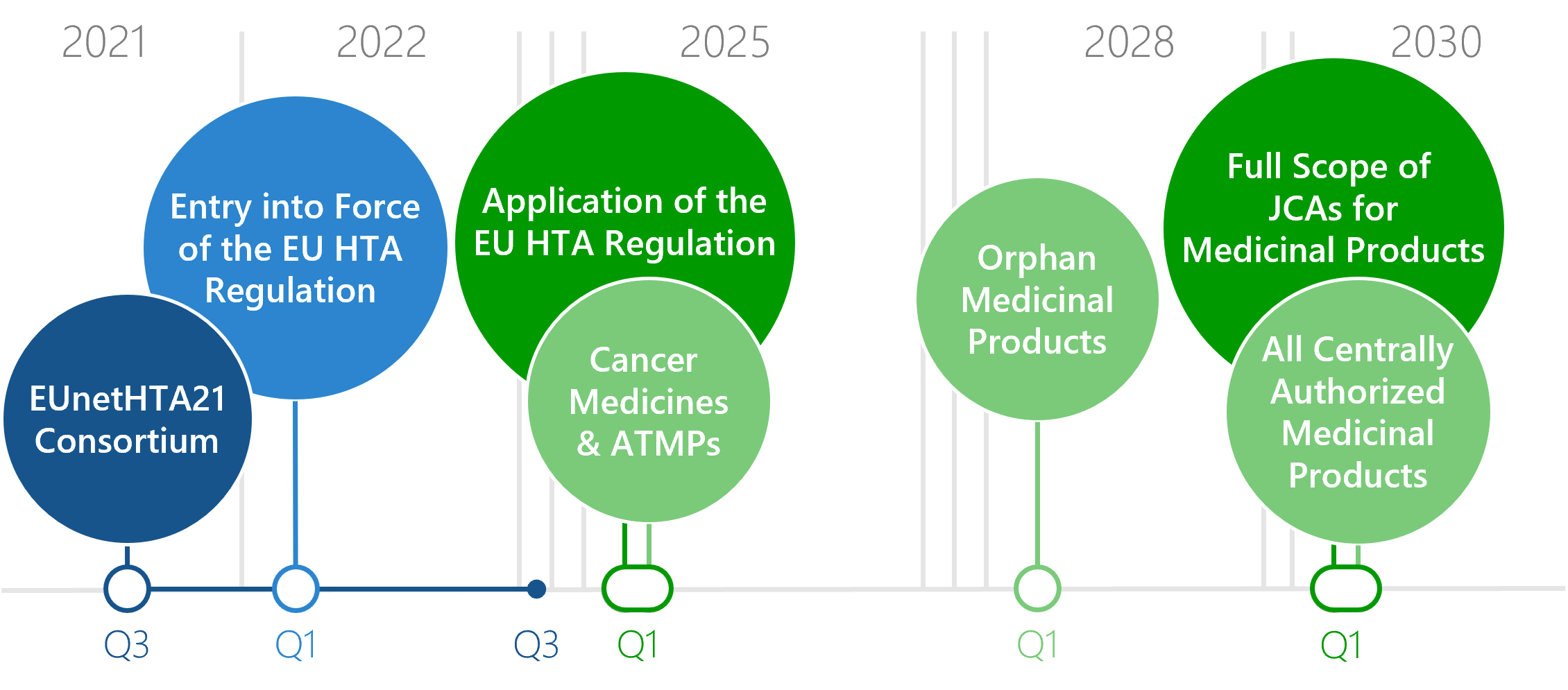
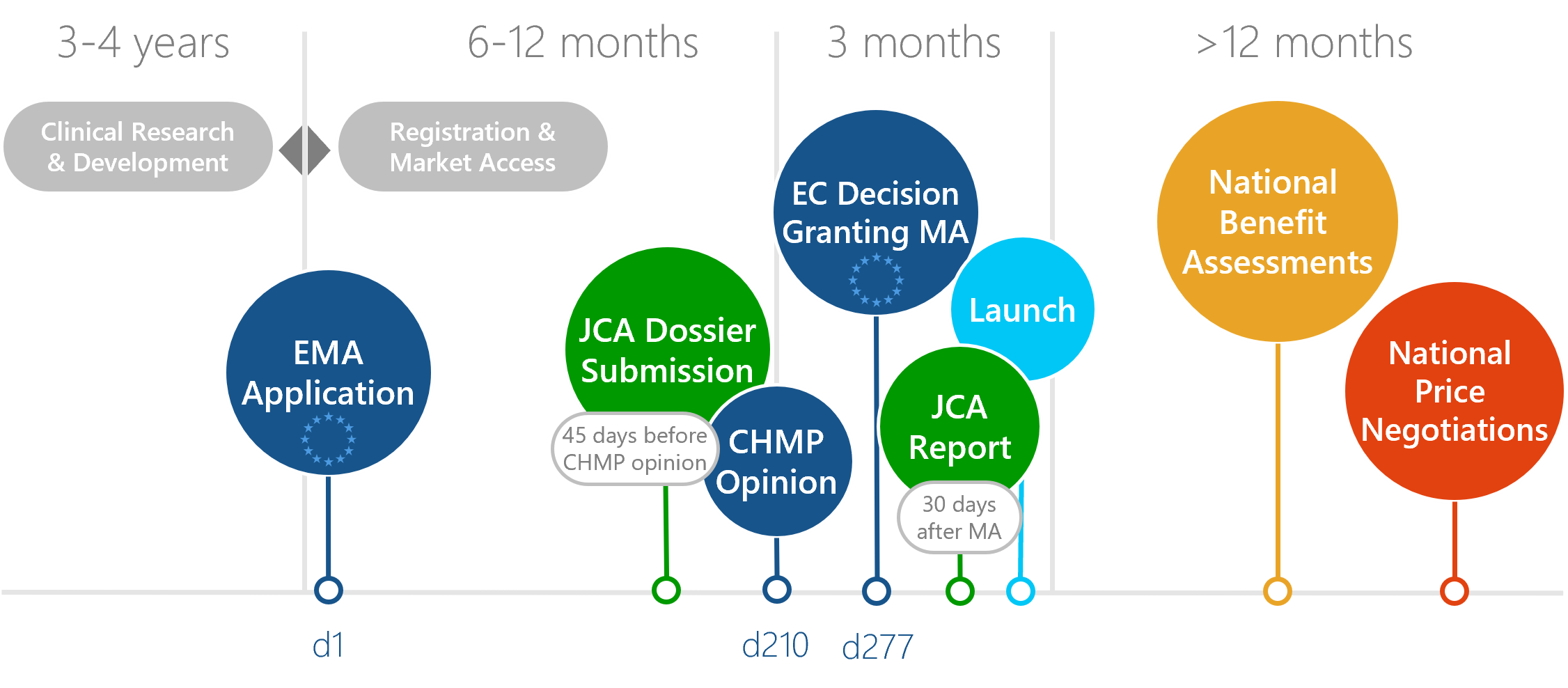
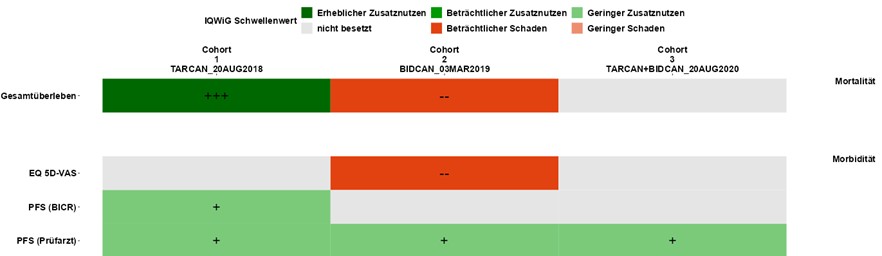
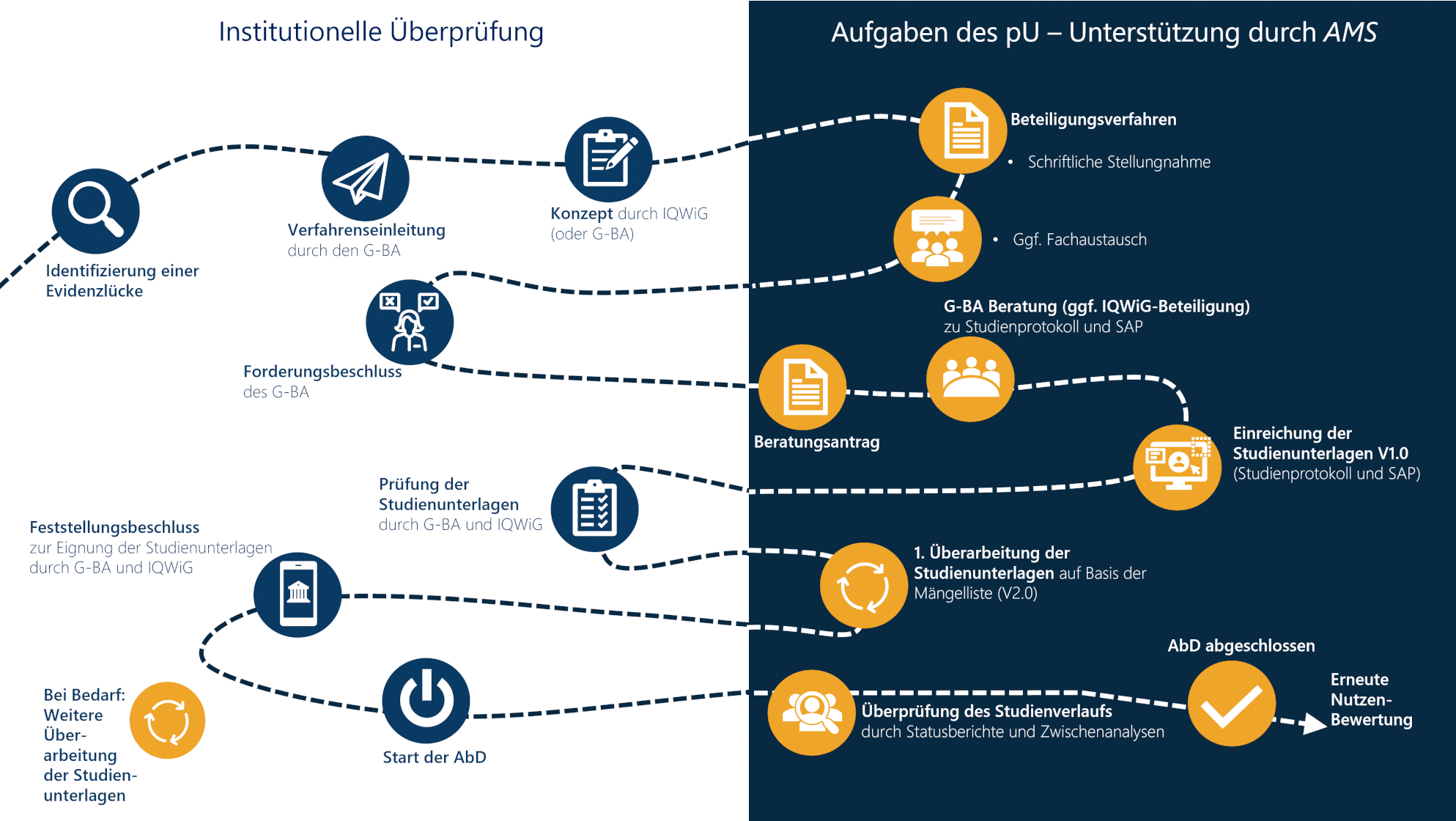
Gut vernetzt und mit einem gemeinsamen Verständnis von Weg und Ziel gelingt es uns, Denkwelten zu vereinen.
Durch unseren engen Austausch mit HTA-Behörden und wissenschaftlich-medizinischen Fachgesellschaften bleiben wir am Puls der Zeit, um Ihr Projekt nach aktuellen Maßstäben zum Erfolg zu führen. Unser multidisziplinäres Medical Science Team aus über 60 Mitarbeitern lebt von dem Zusammenspiel vielfältiger Fachkompetenzen aus Medical Writing, Biostatistik, Projektmanagement, Gesundheitsökonomie und Public Health.
Setzen Sie Ihr Vertrauen in ein starkes, verlässliches Team mit breiter Indikationserfahrung und fundiertem statistischen Wissen, das nach Ihren Erwartungen die Value Story Ihres Produktes abbildet. Mit unserer langjährigen Erfahrung in den Fachgebieten der globalen klinischen Entwicklung, Zulassung, Nutzenbewertung, Preisverhandlung und Kostenerstattung machen wir es uns zur Aufgabe, Ihre Vorstellungen umzusetzen und freuen uns auf den partnerschaftlichen Umgang mit Ihnen auf Augenhöhe.
Nutzen Sie unsere Expertise und unsere Lust auf Neues für Ihren Erfolg. Wir freuen uns auf Ihren Anruf oder Ihre E-Mail.

Dr. med. Alexandra Carls
Director Medical Science
+49 (0) 177 2603 240
Mike Dieser
Associate Director Medical Science
Account Management and Business Organization
+49 (0) 162-4335186
Silke Seemüller
Director Medical Science
Biostatistics
+49 (0) 152-22700506
Dr. Gerlinde Jänel
Strategic consultant
+49 (0) 178-6517769